
Медицинские изделия
Компания «Стародуб» осуществляет поддержку в разработке и регистрации (сертификации) медицинских изделий, включая медицинские изделия I-III класса риска, программное обеспечение, медицинские изделия для in vitro диагностики и комбинированные продукты по всему миру.
Мы также представляем услуги по внедрению и поддержанию системы управления качеством в соответствии с ISO 13485. Мы работаем эффективно с точки зрения финансовых и временных затрат.
Четыре основных принципа нашей работы основаны на обеспечении всеобъемлющего подхода, поиске потенциальных возможностей, выявлении рисков и нахождении оптимальных решений имеющихся вопросов или проблем. Благодаря нашей поддержке клиенты компании «Стародуб» выстраивают благоприятные рабочие отношения с уполномоченными органами и органами здравоохранения по всему миру.
Мы начинаем с обсуждения вашего продукта и определяем, относится ли он к медицинским изделиям, медицинским изделиям для диагностики in vitro или же к комбинированным продуктам. Опираясь на результаты нашего обсуждения, мы формируем стратегию предоставления эффективной поддержки для достижения ваших целей. Когда точные масштабы и бюджет проекта рассчитаны, мы углубляемся в детали.
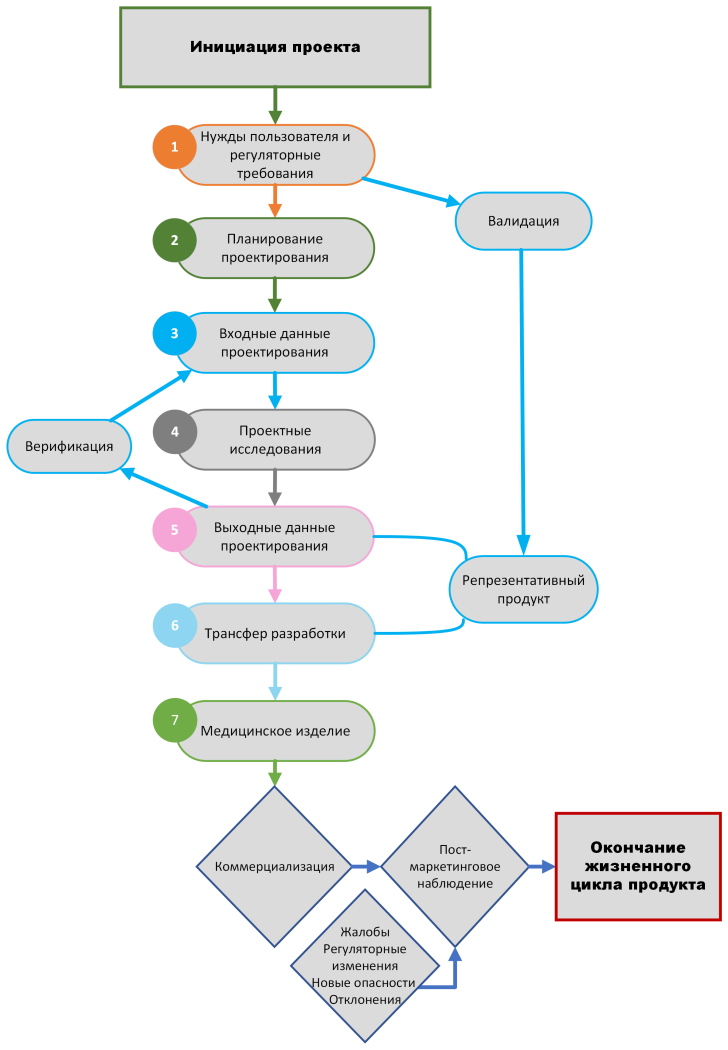
Услуги, которые мы готовы предоставить в течение жизненного цикла вашего медицинского изделия:
Общие
- Квалификация и классификация вашего медицинского изделия в соответствии с действующим законодательством
- Консультирование по вопросам доступа к глобальному рынку, выбора оптимальной регуляторной стратегии и ее реализации
- Выбор уполномоченного агентства, ответственного за оценку, утверждение и маркировку СЕ для медицинских изделий, а также установление профессиональных отношений с выбранным агентством
- Преобразование ваших регистрационных файлов в техническую документацию, соответствующую требованиям Регламента по медицинским изделиям в странах Евросоюза (EU MDR)
- Разъяснение ролей ваших сотрудников, отвечающих за, например, соответствие нормативным требованиям (Person Responsible for Regulatory Compliance – PRRC)
Этап проектирования и разработки медицинских изделий
- Консультирование по спецификациям и требованиям к пользовательским тестам
- Выполнение проверки соответствия общим требованиям безопасности и эффективности медицинских изделий (General safety and performance requirements)
- Написание и / или проверка протоколов верификации и валидации
- Проведение верификации и валидации производительности (эффективности) продукта;
- Проведение верификации и валидации производительности продукта;
- Создание и / или проверка технической документации
- Содействие при подаче регистрационных заявлений и в процессе оценки медицинского изделия уполномоченными органами
- Проведение клинической оценки / оценки производительности, анализа рисков и планирования послепродажного (постмаркетингового) наблюдения

Этап маркетинга
- Нормативно-правовая поддержка при внедрении изменений и / или перепроектировании медицинского изделия
- Проверка системы управления качеством компании на соответствие регуляторным стандартам
- Проведение аудита на соответствие ISO / IEC, включая соответствие ISO 13485, ISO 14971, ISO 14155, IEC 62304, IEC 62366 и другим стандартам
- Проверка соответствия процессов и/или документов, касающихся клинической оценки медицинского изделия, анализа рисков и послепродажного (постмаркетингового) наблюдения на соответствие соответствующим требованиям
- Советы по подготовке к проведению аудитов регуляторными агентствами и поддержка вашей компании во время самой проверки;
- Поддержка по нормативно-правовыми требованиям
Клиническая оценка медицинского изделия
Планирование и проведение клинической оценки медицинского изделия (Clinical and performance evaluation), создание соответствующих планов (Clinical / Performance evaluation plan) и отчетов (Clinical / Performance evaluation report), включая проведение поиска литературных данных, в соответствии с Регламентами Европейского союза 2017/745 (MDR), 2017/746 (IVDR) и другими применимыми руководствами (MEDDEV 2.7/1 и др.).
Анализ рисков
Планирование и проведение анализа рисков медицинских изделий в соответствии с требованиями ISO 14971, включая создание Плана менеджмента риска (Risk management plan, RMP), Отчета по менеджменту риска (Risk management report, RMR), а также Файла менеджмента риска (Risk management file, RMF).
Послепродажное (постмаркетинговое) наблюдение
Планирование послепродажной (постмаркетинговой) деятельности по сбору и анализу данных о безопасности и эффективности медицинского изделия, включая разработку Плана послепродажного (постмаркетингового) наблюдения и Плана послепродажного (постмаркетингового) клинического наблюдения (PMS plan, PMCF/PMPF plan). Оценка данных, полученных вследствие послепродажной (постмаркетинговой) деятельности, включая подготовку соответствующих отчётов: отчет о послепродажной (постмаркетинговой) деятельности (PMS report, PMCF/PMPF evaluation report), периодический обзор по безопасности (PSUR).
Обучение и тренинги
Команда Стародуб предоставляет услуги обучения (тренинги) по Регламенту по медицинским изделиям (MDR), Регламенту по медицинским изделиям для диагностики in vitro (IVDR), стандарту ISO 13485, или же по другим темам по желанию заказчика, на пример по дизайну и разработке медицинских изделий, этапам маркетинга или постмаркетинга, анализу рисков, клинической оценке и клиническим исследованиям. Мы придерживаемся клиенториантированного подхода и разрабатываем тренинги, которые призваны соответствовать конкретным потребностям каждого клиента.
