
Medische hulpmiddelen
Starodub kan u ondersteuning bieden bij de ontwikkeling en registratie van uw medische hulpmiddelen, zoals bij hulpmiddelen van klasse I tot en met III, inclusief software, in-vitrodiagnostische hulpmiddelen en combinatieproducten van medische hulp- en geneesmiddelen wereldwijd.
Wij kunnen u ook helpen bij het opzetten en onderhouden van een kwaliteitmanagementsysteem dat voldoet aan de ISO 13485 standaard. Dit doen wij efficiënt met betrekking tot tijd en kosten.
De vier pijlers van onze aanpak zijn het behouden van helikopteroverzicht, het benutten van potentiële kansen, het communiceren van eventuele risico's en het vinden van de optimale oplossing voor uw vraagstukken.
Dit alles stelt onze cliënten in staat om goede relaties te onderhouden met de aangemelde instanties en geneesmiddelenautoriteiten wereldwijd.
Wij starten altijd met het betwisten en bespreken van de vraag of uw product een medisch hulpmiddel/in-vitrodiagnostisch hulpmiddel of combinatieproduct is, zodat wij u kunnen voorzien van de beste en meest effciënte ondersteuning om uw doelen te bereiken. Wanneer de exacte omvang van en het budget voor het project duidelijk zijn, zullen wij ons verdiepen in de details.
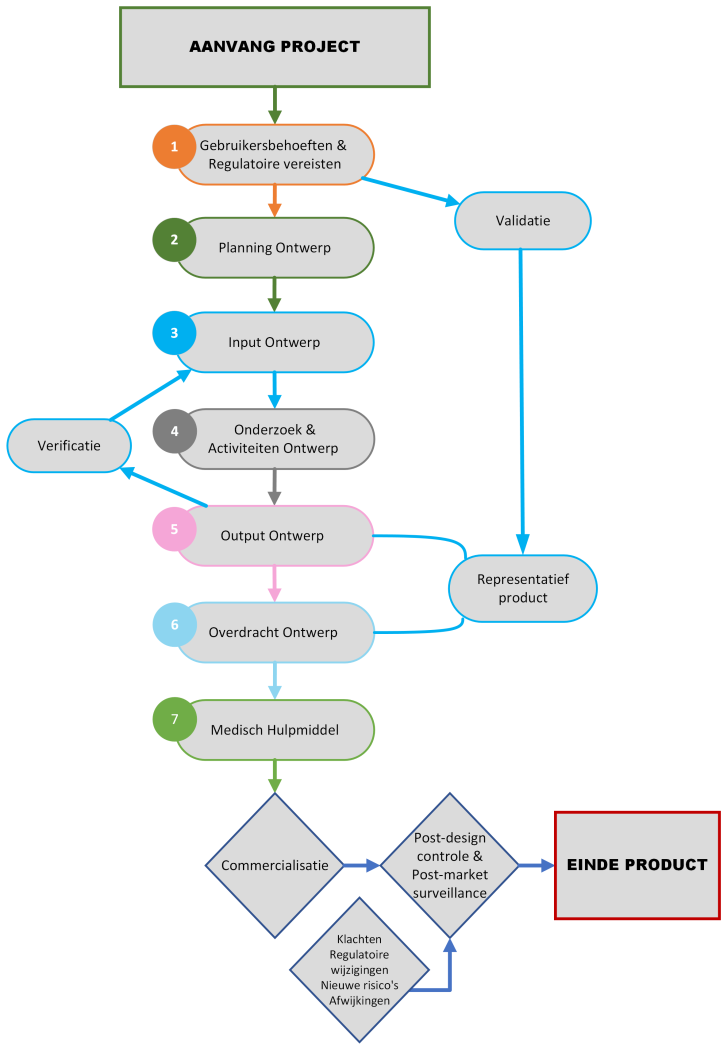
De diensten die we aanbieden tijdens de levenscyclus van uw medisch hulpmiddel zijn:
Algemeen
- Kwalificatie en classificatie van uw medisch hulpmiddel volgens de geldende regelgeving
- Advies over wereldwijde markttoegang, de optimale regulatoire strategie en het uitvoeren van deze strategie in lijn met de gekozen route van conformiteit
- Selectie van beoordelingsinstanties zoals aangemelde instanties en het opbouwen van een professionele relatie met deze instanties
- Omzetten van uw EU registratiebestanden naar de technische documentatie die voldoet aan de EU MDR/IVDR-richtlijnen
- Hulp bij het begrijpen van uw eigen en andere rollen, zoals die van de persoon verantwoordelijk voor de naleving van de regelgeving
Ontwerp- en ontwikkelingsfase
- Adviseren over specificaties en vereisten voor de gebruikerstests
- Uitvoeren van controle op de algemene veiligheids- en prestatie-eisen
- Schrijven en/of reviewen van verificatie- en validatieprotocollen
- Uitvoeren van verificatie en validatie van productprestaties
- Schrijven en/of reviewen van de technische documentatie
- Assistentie bij het indienen en beoordelen van registratieaanvragen van een medisch hulpmiddel door bevoegde instanties
- Plannen en uitvoeren van de klinische/prestatie-evaluatie, risicomanagement en toezicht na het in de handel brengen

Marketingfase
- Ondersteunen van geschikt wijzigingsmanagement bij het herontwerpen van het medisch
- Het uitvoeren van controle op het naleven van het kwaliteitsmanagementsysteem van het bedrijf
- Het uitvoeren van controle op naleving van ISO/IEC standaarden; inclusief naleving volgens ISO 13485, ISO 14971, ISO 14155, IEC 62304, IEC 62366 en andere standaarden
- Uitvoeren van een gap-analyse van processen en/of documenten die gerelateerd zijn aan klinische/prestatie-evaluatie, risicomanagement en toezicht na het in de handel brengen
- Advies ter voorbereiding op inspecties door de regelgevende instanties en advies ter ondersteuning van uw bedrijf tijdens de inspecties zelf
- Ondersteuning met regulatoire wettelijke vereisten
Klinische/prestatie-evaluatie
Het plannen en uitvoeren van een klinische/prestatie-evaluatie met daaropvolgend de ontwikkeling van een klinisch/prestatie-evaluatie plan (CEP/PEP) en een klinisch/prestatie evaluatie rapport (CER/PER), inclusief het uitvoeren van een literatuuronderzoek, in overeenstemming met de relevante bepalingen uit de Verordening (EU) 2017/745 (MDR) of Verordening (EU) 2017/746 (IVDR).
Toezicht na het in de handel brengen
Het plannen en uitvoeren van het risicomanagement voor het medisch hulpmiddel volgens de eisen van ISO 14971 gevolgd door het ontwikkelen van een risicomanagementplan (RMP), risicomanagementrapport (RMR) en het volledige risicomanagementbestand (RMF).
Post marketing
Het plannen van activiteiten na toezicht op het in de handel brengen waaronder het ontwikkelen van een toezicht na het in de handel brengen monitoringsplan (PMS plan) en een toezicht na het in de handel brengen klinische/prestatie opvolgingsplan (PMCF/PMPF) in combinatie met de klinische/prestatie-evaluatie.
Het evalueren van gegevens in een PMCF/PFMF beoordelingsverslag, die verkregen zijn uit een toezicht na het in de handel brengen klinische/prestatie-opvolging. Het samenvatten van alle toezicht na het in de handel brengen-gegevens in een PMS rapport/periodiek veiligheidsverslag (PSUR).
Training
Starodub biedt ook trainingen aan over MDR, IVDR en ISO 13485 of speciale trainingen met specifieke onderwerpen zoals ontwerp en ontwikkeling, het in de handel brengen-fase, toezicht na het in de handel brengen-fase, risicomanagement, klinische/prestatie-evaluatie en klinische onderzoeken.
Wij ontwikkelen klantgerichte trainingen zodat de training aan uw specifieke trainingsdoeleinden voldoet.
